crRNAとそのターゲットDNAとの複合体における黄色ブドウ球菌Cas9の結晶構造
以前の投稿では 、CRISPR / Cas9とゲノム編集へのアプローチについてより詳細に説明するように求められました。前回の投稿では、そのような膨大な資料を含めませんでした。そして、これには、たとえば、TALENメソッドは含めません。これは、より正確になる可能性があり、その利点があります。しかし、最愛の人、はい。
CRISPR-Cas9を使用して、すでに十分に説明されている遺伝子改変の方法をウォークスルーし、それが私たちに開かれる可能性をもう少し広く見てみましょう。私はブタからヒトへの異種移植の方向性に非常に興味を持っていました。最初の「事前修正」法は、そのような豚の移植が体内の体によって殺されることを示しました 数分。しかし、メソッドはまったく破棄されませんでした。それでも、これは別の潜在的な臓器提供者が死ぬまで待つのではなく、事前にそれらを成長させるための有望な方法です。その後、ブタはゲノムに組み込まれた特定のレトロウイルスのパックも持っており、新しい異種動物の流行を引き起こす可能性があることが判明しました。そして、ウイルスも移植前になんとかして摘み取らなければなりません。そして、ここのどこかで、白衣を着た人々がステージに現れ、彼らの研究室で理解できないことをしています...
すべてをひっくり返したバクテリアアンチウイルス
1987年、CRISPRは石野良純が率いる日本の科学者によって発見されました。当時、彼らは大腸菌ゲノムの異常な繰り返しに注意を向けましたが、これを特に重要視していませんでした。そして、遺伝的に大腸菌から非常に遠い古細菌で同様の繰り返しが見つかった場合にのみ、他の原核生物で同様の構造を探し始めました。これらのスニペットはCRISPRと呼ばれます-クラスター化された規則的に間隔を空けた短いパリンドロームリピート。少し後に、特別なCRISPR関連タンパク質であるCas(関連タンパク質 としてのCRISPR )も発見されました。よく発見され、発見されたようです。しかし、それらは新しいバイオテクノロジー革命の始まりでした。
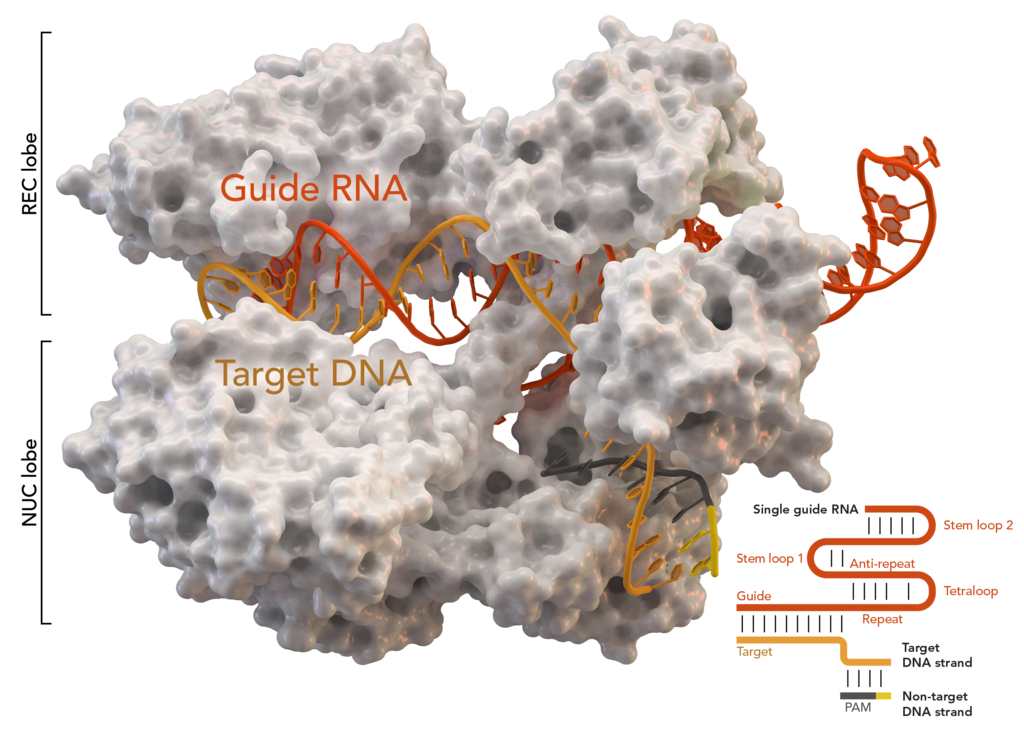
それがどのように機能するのか、そしてなぜバクテリアがそれを必要とするのかをお話ししましょう。バクテリアは生き残りたいと思っています。しかし、彼らはウイルスに寄生するのが好きです。誰かがあなたを食べるとき-それは不快であり、あなたは何かをしなければなりません。その結果、答えは複雑ですが非常に興味深いメカニズムでした。バクテリアは、そのゲノムの一部に、感染しようとしているすべての悪役の署名を大量に保存しています。これらは同じ繰り返しパリンドローム領域です-CRISPR。それらはCasグループのタンパク質と一緒に働きます。キーCas9に興味があります。少し単純化すると、ライブでどのように見えますか?
このシステムが機能しない場合、細菌細胞はバクテリオファージによって注意深く導入されたウイルスゲノムをそれ自体から区別することができません。そして、タンパク質合成のあまり賢くないシステムは、すぐに新世代のファージの放出に向け直されます。細胞は死にます。
CRISPR / Cas9がトリガーされた場合、プロセスは異なります。この細菌は、CRISPRに記録されたデータを使用してコントロールRNAを作成します。タンパク質複合体は、「発射」の前にテストのためにDNAの巻き戻しを開始します。シーケンスがCRISPRに記録されたウイルスシグネチャと一致する場合、Cas9はアラームを発し、認識された敵のフラグメントを即座に遮断します。つまり、ウイルスが「ファームウェア」レベルで細菌ゲノムに埋め込まれていても、組み込みのアンチウイルスがそれを認識するとすぐにそこから切り取られます。
ノーベル賞
EmmanuelleCharpentierとJenniferDoudnaは、CRISPR-Cas9がゲノム編集を実行できるようにする新しいテクノロジーの作成により、2020年のノーベル化学賞を受賞しました。この技術により、当時はより正確であったが、ジンクフィンガーとTALENヌクレアーゼのより複雑で高価な方法を置き換えることが可能になりました。過去の方法では、新しい標的遺伝子座ごとに完全に新しいポリペプチドのペアの開発、発現、検証が必要でした。また、CRISPR-Cas9は標準ツールを提供し、最小バージョンで使用する場合、Cas9が解剖に必要な領域を見つけるために必要な制御シーケンスを取得するだけで十分です。
さて、私たちは人間、酵母、またはテストラットからDNAを切り取りました。これはかっこいいですが、今では2つの壊れた部分と破壊されたチェーンがあります。ステッチバックにはいくつかのオプションがあります。

非相同末端結合法を使用して、カットピースのマッチングを試みることができます。彼は右側にいます。簡単に言うと、このバージョンでは、ダブルブレークを直接ドッキングして、1つの全体に溶接しようとしています。このメカニズムはかなり効果がなく、個々の端部を「取り付ける」過程で脱落する可能性があります。その結果、ブレークゾーンで小さなフラグメントが失われることが多く、逆に短いインサートが表示されます。このアプローチは通常、遺伝子を不可逆的にオフにし、欠陥をもたらします。
2番目のオプションはもっと興味深いものです。彼は右の図にあります。相同組換えによる修復とは、削除された配列を、研究者自身が作成した修復テンプレートに相補的な新しい配列に置き換えることを意味します。その結果、なんらかの方法で遺伝子をオフにするだけでなく、変異配列を正常な配列に置き換えることが可能です。
この方法の主な問題は、確率論的であるということです。はい、多くの場合、正常に機能します。しかし、多くのセルでは、それは望ましい効果をもたらさないか、何かを地獄に壊します。そして、これで単一の細胞だけが死んで、たとえば腫瘍細胞にならないのは良いことです。したがって、このような変更はすべて徹底的にテストする必要があります。幸いなことに、比較的 新鮮なアプローチ カスタムCas9を作成して特異性を向上させると、誤ったカットの数をほぼゼロに減らすことができます。
異種移植片
前に言ったように、これらのテクニックの大規模な使用は特異性を止めます。私たちの素晴らしい分子が単に細胞の20%を見逃しているのであれば、それは大したことではありません。これは、先天性突然変異を持つヒト細胞の80%が固定されており、すでに正しい酵素を生成し始めたり、適切に分裂したり、何か他のことを正しく行ったりすることを意味します。原則として、これは人が臨床的に健康になるのに十分すぎるほどです。
このセクションでは、ゲノム編集が臓器提供の問題をどのように解決できるかについて少しお話したいと思います。移植用の臓器がないのはとても悲しいことだと言わざるを得ません。膨大な待ち時間と多くの倫理的問題。
ロシアで行われる臓器移植の数 は数百分の1ですニーズ。同じ腎臓を適切な親族から移植できる場合、心臓移植はドナーの死を意味することがすでに保証されています。臓器の無制限の供給源を探す上で重要な分野の1つは、異種移植です。これは、異なる種間で組織や臓器を移植するためのオプションです。奇妙なことに、人間にとって構造とサイズの点で最も適切なドナーの1つは ブタです。霊長類は遺伝的に近いですが、一般的にサイズがはるかに小さく、繁殖に非常に費用がかかります。残念ながら、ブタの臓器移植を用いた初期の実験では、血流に接続されてから数分以内に超急性反応で拒絶し始めることが示されました。
豚を変更する方法

移植が拒絶されないようにするためには、少なくとも私たちにとって最も外来のタンパク質の合成に関与する標的遺伝子をノックアウトする必要があります。最初のそのようなタンパク質は酵素α-1,3-ガラクトースであり、これはすべての霊長類で進化の過程で不可逆的に破壊されます。数分以内にごみの始まりを引き起こすのは彼です 。遺伝子修正により、豚の品種を作成することができます 酵素の合成に関与するスイッチオフ遺伝子-ブタGTKO。これにより拒否プロセスが大幅に遅くなりましたが、完全に停止することはありませんでした。霊長類には存在しないN-グリコリルノイラミン酸とβ1,4N-アセチルガラクトサミニルトランスフェラーゼも問題があることが判明した。これらの遺伝子もノックアウトされ、3つの遺伝子すべてを一度にオフにしてブタGGTA1 / CMAH /β4GALNT2KOが得られました。おそらく、これは拒絶反応を実質的に中和することができ ます。理論的には、豚の細胞に人の表面糖タンパク質CD47を合成させることも判明した場合、適合性は 非常に優れています。
2018年には非常に有望な出版物がありました GMO豚からヒヒへの心臓移植について。5頭のヒヒのうち、問題があったのは1頭だけでした。肺水腫は外科的理由で始まり、事前に実験から撤退する必要がありました。残りは実験期間が終わるまで健康で生き残った。2〜3か月と2〜6か月。豚の心臓はヒヒよりも大きいので、臓器の成長に問題がありましたが、人にとっては問題ありません。
私たちの前に新しいHIVはありますか?

チンパンジーのHIVおよび関連ウイルスの系統樹
明るい未来が私たちを待っているように思われます。そこでは、特別な実験用豚の別の群れがドナー臓器の生産のために放牧されます。しかし、ここでも、多くの倫理的問題が発生しています。そのような方法は、いくつかの宗教の代表者には受け入れられず、世界の人口の大部分が自動的にアクセスできなくなるのではないかと思います。
豚にもレトロウイルスがあります。これらには、例えば、ヒト免疫不全ウイルスおよび関連する霊長類ウイルスなどの素晴らしいレンチウイルスが含まれます。前世紀の70年代に大規模なHIVの流行を引き起こしたのは、霊長類のウイルスであったと考えられています。そして今、人は彼をどうするかを知りません。ブタはPERVの保因者です-ブタの内在性レトロウイルス。また、ウイルスはすでに細胞のゲノムにしっかりと埋め込まれているため、慎重な繁殖とエピデミック対策によってこれらのウイルスを取り除くことはできません。調査が行われました これは可能な解決策を与えるはずです。まず、ブタの細胞を採取し、ヒトの腎臓の胚性細胞と同じ培養で増殖させました。最も厄介なのは、ブタのレトロウイルスに感染したヒト細胞を特定できたことです。これは、移植の可能性を示している可能性があります。解決策として、彼らはCRISPR-Cas9による細胞の前処理と、ブタ腎上皮細胞の培養からのすべてのウイルス断片の完全な切除を提案しました。
バイオテクノロジーとリスク
これらすべてがどこにつながるかを予測することは困難です。残念ながら、そのような移植からエキゾチックなウイルス変異体を得るリスクはゼロにはほど遠いです。そして、そのような感染症は、HIVの時代に起こったように、明らかになる前に、静かにそしていつの間にか広がる可能性もあります。それでも私はかなり楽観的です。私たちは研究の過程で必然的に多くの熊手を踏むでしょうが、今では以前は致命的だった病気を治療し、人間の寿命を延ばすためのツールがあります。
